#Chemistry Challenge 6
English (deutsche Übersetzung unten!)
Today I would like to open up the next round of my #chemistrychallenge.
What could be more fun than activating your brain and at the same time having the opportunity to win up to 20 STEEM. :-)
Rules - what are the requirements to win the prize?
The winner is the first person to post the correct solutions (correct numbers and correct units; solution process required). The prize for the correct answers is 20 STEEM. I will send it to the winner immediately after the article is paid out (seven days after posting).
Should the various solutions be spotted by different users I will distribute the prize money of altogether 20 STEEM at my own discretion amongst the winners.
If nobody is able to determine the solutions before Thursday, February 1st, 2018 at 10 pm (German time!) the prize (20 STEEM) will be sent to the person with the best approach.
Special thanks to the SteemSTEM community! They support this challenge which means that they contribute half of the prize money (= 10 STEEM)! In my eyes this still growing science community adds a lot of value to our Steemit platform! If you are interested in 'STEM' (= Science, Technology, Engineering, Mathematics) you may check their blog and read their last project update.
Your Chemistry Challenge to Solve:
The mass of all worker bees within a beehive in summer is about 4 kg.
10 bees have an overall mass of 1 g.
Within 20 days one single bee collects enough nectar to produce 9 g of honey (about one teaspoon).
Let's assume that the honey contains 80 % (mass percentage) sugar from which 37.5 % are glucose (C6H12O6). The molar mass of glucose is M(C6H12O6) = 180 g/mol.
Questions:
a)
Let's assume that all worker bees of this beehive would collect nectar simultaneously.
- How many minutes would they need to collect enough nectar to produce exactly 500 g honey?
- How many mols and how many molecules of glucose would that amount of honey contain?
b)
|
The 500 g honey fit into a cylindrical honey jar.
What is the density of the honey? |
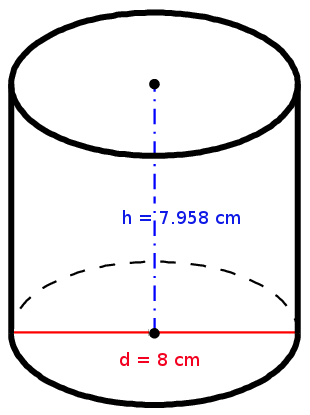 |
c)
Now let's assume that you eat exactly one-tenth of the honey in this honey jar to be fit enough to solve the last part of the challenge. :)
In your metabolism the glucose contained in the eaten honey is now oxidized by means of oxygen to CO2 and H2O (process of cellular respiration).
Which amount of energy ΔHR will be released from the eaten glucose during this degradation process?
Let's assume that under the given conditions (pressure, temperature) the following molar enthalpies of formation would apply:
ΔHf(H2O) = - 285.9 kJ/mol.
ΔHf(CO2) = - 393.5 kJ/mol.
ΔHf(C6H12O6) = - 1268 kJ/mol.

Deutsch
Heute möchte ich die nächste Runde meiner #chemistrychallenge eröffnen.
Was könnte mehr Spaß bereiten, als mal wieder sein Gehirn zu aktivieren und dabei zugleich die Gelegenheit zu ergreifen, bis zu 20 STEEM zu gewinnen. Also macht euch an die Arbeit! :-)
Regeln - welche Bedingungen müssen erfüllt sein, um den Preis zu gewinnen?
Gewinner ist derjenige, der zuerst die korrekten Lösungen (korrekte Zahlen und korrekte Einheiten; Lösungsweg erforderlich) nennt. Der Preis für die korrekten Antworten beträgt insgesamt 20 STEEM. Ich werde ihn dem Gewinner direkt nach der Vollendung der Auszahlungsperiode dieses Artikels (also sieben Tage nach seiner Veröffentlichung) gutschreiben.
Sollten die verschiedenen Lösungen von verschiedenen Usern gefunden werden, verteile ich das Preisgeld von insgesamt 20 STEEM nach eigenem Ermessen unter den Gewinnern.
Solle niemand die Lösungen vor Donnerstag, den 01.02.2018 um 22:00 Uhr (deutsche Zeit!) herausfinden, wird der Preis (20 STEEM) demjenigen gutgeschrieben, der den besten Lösungsansatz vorzuweisen hatte.
Mein besonderer Dank gilt der SteemSTEM-Community, die diese Challenge unterstüzt, indem sie die Hälfte des Preisgeldes (= 10 STEEM) beisteuert! In meinen Augen ist diese noch wachsende Wissenschafts-Community ein wertvoller Bestandteil der Steemit-Plattform! Wenn du dich für 'STEM' (= Science, Technology, Engineering, Mathematics) interessierst, empfehle ich dir, ihren Blog anzusehen und das letzte Projekt-Update zu lesen.
Hier nun die zu lösende 'Chemistry Challenge':
Die Masse aller Arbeitsbienen eines Bienenvolks im Sommer betrage 4 kg.
10 Bienen haben eine Masse von zusammen 1 g.
Innerhalb von 20 Tagen sammelt eine einzelne Biene genug Nektar, um davon 9 g Honig (ungefähr den Inhalt eines Teelöffels) produzieren zu können.
Angenommen, der Honig enthalte 80 % (Massenanteil) Zucker, wovon 37,5 % Glucose (C6H12O6) seien. Die molare Masse von Glucose beträgt M(C6H12O6) = 180 g/mol.
Fragen:
a)
Nehmen wir an, alle Arbeitsbienen des Bienenvolks würden gleichzeitig Nektar sammeln.
- Wie viele Minuten würden sie benötigen, um genug Nektar zu sammeln, um davon genau 500 g Honig zu produzieren?
- Wie viel mol und wie viele Moleküle Glucose wären in dieser Honigmenge enthalten?
b)
c)
Lasst uns nun annehmen, du würdest genau ein Zehntel des in diesem Glas enthaltenen Honigs essen, um fit genug für den letzten Teil dieser Challenge zu sein. :)
In deinem Stoffwechsel wird nun die im verzehrten Honig enthaltene Glucose mit Hilfe von Sauerstoff zu CO2 und H2O oxidiert (Prozess der aeroben Atmung).
Welche Energiemenge ΔHR wird bei diesem Abbauprozess der gegessenen Glucose freigesetzt?
Lasst uns weiterhin annehmen, unter den gegebenen Bedingungen (Druck, Temperatur) herrschten folgende molare Bildungsenthalpien:
ΔHf(H2O) = - 285,9 kJ/mol.
ΔHf(CO2) = - 393,5 kJ/mol.
ΔHf(C6H12O6) = - 1268 kJ/mol.

Hey Jaki!
Offen und ehrlich gesagt wäre ich bei dieser Aufgabe komplett verloren und hätte da null Chance. Zumal ich auch noch viel zu spät dran wäre :)
Allerdings verdient alleine deine Arbeit solch eine Aufgabe zu stellen und solch einen Post zu schreiben die volle Unterstützung 😁
100% UPVOTED 👍
Let me try to give it a shot:
Q1
1 bee implies 0.1 gram; 4 kg bee implies 40000 bees
honey production rate = 9/20 gram/bee/day, implies 0.08 min per gram of honey.
500 gram honey = 150 gram glucose
Q2
Density = mass / vol = 500 /(Pi(4)27.958)
Q3
Enthalpy of reaction:
C6H12O6 + 6 O2 --> 6CO2 + 6 H2O
by completing the Hess cycle,
The required enthalpy = (-393.5)(6) + (-285.9)(6) - (-1268)
Opus I forgot that was 1/10 of the honey. So I edit add a few line here:
Consumed honey = 50 gram = 15 gram glucose = 0.0833333 mole =
so ΔHR = -234 kJ
Right! So @jedigeiss 'stole' you this part of the solution because he was faster! :)
Well done nevertheless - hope you enjoyed the competition! (I will send you 3 STEEM.)
Haha !! That was really fun!!! This is probably the first time for me to work on a Hess cycle in the recent five years. Really took me some time back to the definition and make sure I didnt remember things wrongly XDD
A 1:
6250 min40 minA 2: 0.8333.. mol and 4.99821023 molcules
B: 0.3125g/cm*3
C: -48.85 kJ/mol
B: 500g/400cm ** 3 = 1.25 g/cm ** 3
(4**2 * 3.141 * 7. 958)
That looks better now ... :)
I suggest you to check the exact number of the molecules (part a)) again.
Also part c) is still wrong ...
Tonight.
For the chemistry stuff I have to get back to Wikipedia and reread some parts.
I guess someone is already picking up my mistakes :))
Part of the price money is already yours ...
Part c) is most difficult maybe ...
Nice that you tried it, but most of it (not everything) is still wrong ... (I didn't give you more details for now not to give anybody any early hint ...)
That's the best I could do on my mobile phone :)
Will try later if no one answered
So far without any doubt your answers are the best ones (not to say: the only ones). :)
Can you check my answer in steemd?
Because the markup here is destroying my * 10**23
You can write it by using <sup>text</sup>
1023
Good that you didn't delete completely but striked out the old solution so that I can follow your solving process better. However, there are still some wrong answers ... :)
That bloody
AvocadoAVOGADRO .. Why isn't it a well rounded number like Pi!Oh.. I see.. :)
EDIT: Avogadro and avocado are spellchecker mistakes on my phone.. Sorry.. Lol:)
Top and bottom of the cylinder are circle areas ... That part shouldn't be toooo difficult ...
Lol, that was funny indeed! :)
hi @jaki01, crap that i saw this now i need to try to solve it.
for a its 40 min, thats correct.
a2,0,833 periode is also right, i get 5,018 * 10^23 molecules
b,die Dichte beträgt 1,24 g /cm3
c,49,04 kJ
i dont know, i was never brilliant in chemistry ..
;D
Kind regards
Jan
new answer
well since C6H12O6 + 6 O2 --> 6CO2 + 6 H2O is correct and 2808,4kJ/mol as well
you only need to see that you are taking a tenth of 0,83 period of mol meaning 0,083 period
this results in 234 kj
Well done! However, @isnochys found some of the solutions faster! :)
Hi @jaki01. Here my answers:
a) t=40min, 0.833 mols and 5,016x1023 molecules
b)ρ=1,250 g/cm3
c)ΔHr=-2808,4 KJ/mol
is it late?
Part c) is incorrect. The correct answer is -233KJ as @jedigeis said!
I apologize.
No need to apologize! You did well, but the some other Steemians were faster this time! :)
Chemistry is not my strong, I prefer mechanics, but I like very much thermodynamics , it's ironic, right?
Thanks for this challenge @jaki01, it was very interesting.
Really nice to hear that you liked it ...
A. 1. 45 mints..
2. 0.9457. mol and 4.12654 molcules
B. 0.3125g/cm3
C. 24.5kj/mol
Thanks for taking part as well, but your solutions are not yet correct. :)
Ohhh...
My chemistry knowledge is not good...but....I can try again?...
Sure!
A: (1) 40 minutes. (2) 2.78 mol, 1.67*10^24 molecules
B: 1249.96 kg/m3
C: -780.11 KJ
A
1: for time
no of bees = 40,000
in a 20 day period the weight of honey produced by them = 360000 g
using the direct relation between time and wt, we get 1/36 day = 24/36 hr = 40 min
2: for no of moles
mass percentage of glucose= 80%of37.5%of500= 150g of glucose
no of mols= 150/180= 0.833 mol
no of molecules= 150/180* Avogadro's number= 5.091*10^23 molecules
B
volume of cylinder = pir^2h where r=0.04m
density = mass/volume = 1249.96 kg/m3
C
From Hess's law
Energy released when 1 mol of glucose is burned is -2808.4 KJ
since, 1/10th of honey is equivalent to 15 g of glucose, using the simple unitary method we get -234.033 KJ
Apart from the number of molecules that looks really good! However, some other Steemians were faster this time! :)
I hope you enjoyed the competition nevertheless!
Yeah i did. Thank you for encouraging this kind of posts. TBH, i dont know how to use the power function here, so just used raised to the '^'
You can write it by using <sup>text</sup>
For example: 1023
Thank you :). And about the number of molecules, i was contemplating till now and realized what you meant. But here in our country, we're taught that the base of Avogadro's no is 6.023 and not 6.022. This was in high school and it's still embedded in me. And again Thank you and will keep an eye out for your contests. CHEERS!
A:(2) 0.833 mol , 5.091*10^23 molecules
C: -233.7(-234.033, my bad) KJ, bad habit of skipping lines.
haha know my 2 is wrong. I'll redo it. Didn't see the mass % part. Also C. 1/10 th of the honey not glucose.
@jaki01 : since i did in my notebook, do i need to post the photos?
Ich muss mich leider aus dem Wettbewerb verabschieden, ohne überhaupt teilgenommen zu haben.
Chemie hatte ich nur bis zur Mittelstufe und Mathe ist auch heute noch das Fach, durch das ich mich im Studium kämpfen muss haha
Vielleicht hab ich beim nächsten bessere Chancen :P
Wie? Was? Eine Stunde und noch keine korrekte Antwort? Wo sind unsere Wissenschaftler heute? da habe ich ja direkt eine Chance. Da ich auf dem Steem als multible Persönlichkeit agiere, fangen wir mal an. Der Frosch, Afro–G, das Orakel, der Witnessblower und ich. Zusammen werden wir das doch schaffen!
4000g x 10 = 40000 Bienen.
In 20 Tagen, also 28800 Minuten sammeln 40000 Bienen 9g x 40000= 360000g Honig!
360000/100 = 3600 x 8 = 28800g Zucker, mit 10800g Glukoseanteil (37,5%) was 60 mol sind (molekulare Masse).
1 mol sind 6,022 · 1023 Teilchen, Atome
Sie sammeln innerhalb von 28800 Minuten 360000g Honig.
360000/28800 = 12,5 g/min
500/12,5 = 40
Antwort a) 40 Minuten. 60 mol und
Ich habe an dem Punkt aufgegeben:
180,16 g·mol−1.
Habe noch meinen Freund angerufen, der war Mathematiker und der meinte ich soll durch das, was davor steht dividieren. Hoch minus Eins. Die Wurzel aus Eins ist es noch nicht. Aber so was Ähnliches.
Sehr gut, also, die Minutenzahl ist schon mal richtig!
Als Molmasse der Glucose kannst du den von mir gegebenen Wert 180 g/mol nehmen.
Allerdings musst du erst die Honigmasse, 500 g, mit 0,8 und dann mit 0,375 multiplizieren, um die Glucosemasse in 500 g Honig zu berechnen. Danach gilt: Die Anzahl der Mole ist Masse dividiert durch Molmasse, also n = m/M = 150 g / 180 g/mol = 5/6 mol.
Allerdings ist das schon gelöst worden, siehe oben!
Du weißt doch, lieber @Jaki01: Ich bin seit Monaten viel zu langsam. Beim Schach ist auch schon immer alles gelöst. Trotzdem hat es immer Riesenspaß gemacht.