Aislamiento y caracterización de ADN extraído del hígado de ratón (Mus musculus)
Los ácidos nucleicos como el ADN son compuestos que actúan en el almacenamiento y en la transferencia de información genética, por lo que, son de gran interés médico y biotecnológico. En el presente estudio, se trabajó para la extracción de ADN del hígado de un ratón (Mus musculus), y a su vez, para caracterizar las moléculas que lo componen. El proceso de extracción se basó en la homogenización del tejido hepático y la posterior separación del ADN del resto de los componentes celulares en base a la solubilidad de estos en distintos solventes y quelantes, tales como el buffer TES, SDS y mezcla cloroformo-fenol, finalmente precipitando el ADN usando etanol frio. En la fase de caracterización, se evaluó el efecto hipercrómico y se cuantificó la muestra de ADN mediante espectrofotometría, también se buscó detectar la presencia de fosfatos y pentosas mediante las reacciones cualitativas del fosfomolibdato de amonio y Bial respectivamente.
A una longitud de onda de 260 nm se determinó que la muestra contenía 0,2785 mg de ADN por g de hígado, y además, se pudo determinar de manera aproximada que el número máximo de células por gramo de hígado era 6,05x107 y el peso de cada célula hepática de 1,65x10-8 g. Usando como referencia la lectura a 280 nm se determinó la pureza de la muestra de ADN calculando el cociente 260/280, para el cual se obtuvo un valor de 1,5, indicando así una ligera contaminación por proteínas. Al calentar la muestra, las absorbancias aumentaron de manera considerable poniendo en evidencia el efecto hipercrómico. Para finalizar, las reacciones cualitativas realizadas permitieron detectar la presencia de grupos fosfato en la muestra final de ADN y además la presencia de pentosas.
INTRODUCCIÓN
El ácido desoxirribonucleico (ADN) y el ácido ribonucleico (ARN) son macromoléculas centenarias que actúan en el almacenamiento y en la transferencia de la información genética [1]. El ADN es un polímero lineal de residuos de nucleótidos (desoxinucleótidos) unidos por enlaces fosfodiester entre las posiciones 3’ y 5’ de las moléculas de desoxirribosa [2]. Cada nucleótido contiene tres componentes característicos: una base nitrogenada, una pentosa y una molécula de ácido fosfórico[1].
La extracción y el aislamiento del ADN de un tejido son procedimientos clave para la caracterización y el estudio de éste con distintos fines, es por esto que se considera como prioritaria la obtención de un ADN de buena calidad sin contaminantes de ARN o proteína, lo cual permitirá su utilización en técnicas posteriores minimizando la posibilidad de interferencias por acción de alguna enzima [3]. El proceso general de aislamiento involucra tres pasos: primero, la lisis de las membranas celulares, mediante el uso de buffer específicos y altas tensiones; segundo, la separación y degradación de proteínas empleando solventes o sales saturadas; tercero, la extracción del ADN y su precipitación mediante el uso de alcoholes [4] Una vez aislado el ADN, el análisis de la absorción UV de los nucleótidos constituye un método simple y confiable para la determinación de la concentración de ácidos nucleicos en una muestra. Las bases nitrogenadas purinas y pirimidinas de los ácidos nucleicos muestran una absorción máxima a 260 nm, mientras que la lectura a 280 nm proporciona la cantidad de proteínas en la muestra [4]. El cociente o proporción entre las lecturas a 260 y 280 nm (260/280) permite conocer la pureza del ADN, si éste se encuentra puro, el cociente estará entre 1,8 y 2, si está por debajo de 1,8 entonces la muestra contiene proteínas, y si está por encima de 2, contiene ARN, en todo caso, la densidad óptica del ADN de doble cadena a 260 nm es de 50 μg/ml [3].
La caracterización de una muestra de ADN, incluye distintos procedimientos que permiten conocer su composición y comportamiento. La reacción del fosfomolibdato de amonio por ejemplo, permite la detección de grupos fosfato al hacerlos reaccionar con molibdato de amonio, formando un precipitado amarillo [5], otras reacciones como la de Bial, se basan en la formación de derivados del furfural a partir de azucares, los cuales luego se hacen reaccionar con Orcinol en presencia de ión férrico para formar compuestos coloreados de verde, indicando la presencia de pentosas [6]. Por otra parte, procedimientos como el calentamiento prolongado, generan aumentos en la absorbancia de las muestras de ADN, fenómeno conocido como efecto hipercrómico [1].
El ADN es particularmente abundante en las células hepáticas, ya que en el hígado ocurre la síntesis y control de los aminoácidos en el plasma sanguíneo [7], en ratones comunes (Mus musculus) se sabe que este órgano puede llegar a pesar hasta unos 2 g y contener entre 2,49 [8] y 2,34 [9] mg de ADN por g de hígado. En el presente estudio, se describe el proceso de aislamiento y extracción del ADN contenido en el hígado de ratón (Mus musculus) para su cuantificación mediante espectroscopía. Se reporta también la caracterización del ADN extraído evaluando el efecto hipercrómico, y la presencia de fosfatos y pentosas en este.
MATERIALES Y MÉTODOS
Extracción de ácidos nucleicos
Para obtener el ADN se empleó un hígado de ratón (Mus musculus) el cual se lavó para quitar la sangre usando NaCl al 0,9 %, se pesó y fue luego cortado y macerado. A esta masa se le agregaron 10 ml de tampón TES y se colocó en el homogeneizador de tejidos efectuando entre 8 y 10 pases con el émbolo. Dicha solución fue luego filtrada a través de gasa, se le midió el volumen y se completó hasta 50 ml con TES.
A 9 ml de los 50 ml de solución preparados, se le agregaron 3ml de sacarosa 0.2 M cuidando la formación de una interfase en el tubo, el cual fue luego centrifugado por 10 min a 3000 rpm (Microcentrífuga Labnet). El precipitado fue resuspendido en 4 ml de tampón TES y se le agregaron 1 ml de SDS al 10% y 7 ml de mezcla de extracción cloroformofenol, esta nueva solución fue agitada vigorosamente por 5 min (con ayuda del vortex) antes de ser centrifugada por 10 min a 3000 rpm nuevamente. La fase acuosa (sobrenadante) se extrajo y se le volvió a adicionar 5 ml de la mezcla de extracción para luego centrifugar una vez más en las mismas condiciones. Finalmente, se extrajo este último sobrenadante y se le adicionaron 21/2 volúmenes de etanol frio. Se agitó y se extrajo el ADN precipitado en forma de material fibroso con ayuda de una varilla, para ser diluido en 6 ml de NaCl al 0,9 %, constituyendo así la fracción de ADN concentrado.
Absorción de luz y efecto hipercrómico
Se realizó una dilución 1/6 a partir de la solución de ADN concentrado usando NaCl al 0,9%, parte de esta solución se calentó por 15 minutos y seguidamente, se determinó la absorbancia a 260 y 280 nm para ambas fracciones (la caliente y la que estaba a temperatura ambiente) empleando el espectrofotómetro (Thermo Scientific GENESYS 10 UV-Vis). Posteriormente se calculó el cociente 260/280 para conocer la pureza del extracto de ADN.
Determinación cualitativa de fosfato
Fueron tomados 0,5 ml de la dilución 1/6 de ADN en NaCl al 0,9% a los que se les agregó 1 ml de H2SO4 30% v/v, y se calentó en el mechero hasta observar un cambio de color en la solución. Se procedió entonces, a añadir 4-5 gotas de perhidrol y se continuó calentando hasta la obtención de una solución incolora. Por último, se adicionó molibdato de amonio al 2,5% p/v esperando la aparición de una coloración amarilla.
Determinación cualitativa de desoxirribosa
Se le agregaron 2,5 ml del reactivo de Bial a 0,5 ml de la solución de ADN concentrado y se procedió a calentar en agua hirviente por 10 min. Se esperó la aparición de una coloración verdosa.

Figura 1: Formulas empleadas en este trabajo para el cálculo de las variables de interés.
RESULTADOS
Extracción de ADN del hígado de ratón usado
El hígado pesó 1,7052 g y al cortarlo, macerar y homogeneizarlo resultó una solución blancuzca que fue luego filtrada obteniéndose 6,2 ml de esta. Posteriormente, se formó una interfase al agregar la sacarosa y después de la centrifugación, se obtuvo un precipitado rojizo (Fig. 2). Finalmente, después de la última centrifugación y al agregar etanol frio se obtuvo una fina capa o masa de un material blanco fibroso, el ADN precipitado.

Figura 2: Formación de un precipitado rojizo.
Contenido de ADN en el hígado del ratón usado, y número y peso aproximado de células por g de hígado.
Tomando como referencia una densidad óptica teórica de 50 μg/ml para ADN de doble cadena y la absorbancia medida para la solución de ADN diluido (1/6) a 260 nm a temperatura ambiente se calculó la cantidad de ADN presente en la muestra, además se pudo determinar de manera aproximada el número máximo de células por gramo de hígado y el peso de cada célula hepática en base a que 4,2 picogramos de ADN equivalen a 1 célula de ratón (Tabla I).
Tabla I: Contenido de ADN en el hígado de ratón empleado, número de células máximo por g y peso aproximado de la célula hepática.
| Tejido | Cantidad de ADN (mg/g) | Número máximo de células (#cel/g) | Peso aproximado de células hepáticas (g) |
|---|---|---|---|
| Higado de ratón | 0,2785 | 6,05x107 | 1,65x10-8 |
Caracterización de la muestra de ADN
Efecto hipercrómico
Al medir las absorbancias en el espectrofotómetro a 260 y 280 nm antes de calentar se obtuvieron distintos medidas con las cuales se calculó el cociente 260/280 (Tabla II). En base al valor del cociente se determinó que el extracto de ADN obtenido se encontraba ligeramente contaminado con proteínas. También se evidenció un aumento en las absorbancias de la muestra después de haber calentado, tanto para 260 como para 280 nm.
Tabla II: Absorbancias de la muestra de ADN a temperatura ambiente y después del calentamiento a 260 y 280 nm, además se muestra el cociente 260/280.
| Fracción de ADN diluido | Temperatura inicial (ºC) | Temperatura final (ºC) | Cociente 260/280 |
|---|---|---|---|
| Absorbancia a 260 nm | 0,285 | 0,351 | 1,5 |
| Absorbancia a 280 nm | 0,190 | 0,255 | 1,5 |
Determinación cualitativa de fosfatos
Luego del calentamiento, se observó la aparición de color amarillo (Fig. 3) característico de la formación de fosfomolibdato de amonio en la solución, indicativo de la presencia de fosfato en la solución y por ende, en la molécula de ADN.

Figura 3: Formación de precipitado amarillo indicativo de la producción de fosfomolibdato de amonio.
Determinación cualitativa de pentosas
Al adicionar el reactivo de Bial a la solución, y posteriormente calentarla, se observó la aparición de un color verdoso en la solución (Fig. 4) característico de la presencia de pentosas en dicha solución y por ende, presentes también en la molécula de ADN.

Figura 4: Aparición de color verdoso en la solución como resultado positivo para la prueba de Bial.
DISCUSIÓN
Proceso de extracción del ADN
El hígado de ratón fue usado para la extracción del ADN ya que este es el órgano más grande y contiene una gran cantidad de un tipo único de células [10], haciendo más fácil el aislamiento, y garantizando que la cantidad de ADN sea relativamente homogénea en todas las células del órgano; una vez que este fue removido del ratón (Mus musculus) se lavó con NaCl al 0,9 % (o 0,1 M) ya que dicha concentración corresponde a la misma concentración dentro de las células [11], evitando que estas sufran plasmólisis o crenación y por consiguiente que la cantidad de ADN en la muestra se vea afectada.
Después de lavado, se cortó y maceró usando tampón TES, el cual contiene NaCl 0,1 M, que proporciona un medio isotónico y protege osmóticamente la célula; buffer Tris que mantiene el pH en 7,5 (cercano al pH fisiológico 7,4 [7]) y evita desnaturalización de proteínas y otros componentes celulares, y EDTA o ácido etilendiaminotetraacético el cual atrapa iones de metales divalentes (agente quelante) necesarios para la actividad de las nucleasas [12], inhibiéndolas y así evitando que estas degraden el ADN. Posteriormente se homogeneizó (se obtuvo un extracto en donde se encuentran todos los componentes celulares) de manera mecánica forzando a las células a pasar por un tubo de vidrio por acción de un pistón giratorio con un estrecho margen de tolerancia [11], que terminó por romper las membranas de las células hepáticas.
Una vez obtenida la fracción de homogenato y después de ser filtrada para limpiarla de porciones de material grandes, se le agregó una capa de sacarosa y se centrifugó, obteniendo un precipitado, constituido por la fracción nuclear. Lo que ocurrió fue que al crear una capa de sacarosa sobre la solución (por ser menos densa) y luego centrifugar, todos los componentes celulares más densos que la sacarosa precipitaron, en este caso, los núcleos y los menos densos o igual de densos quedan diluidos en el azúcar, debido a que sus densidades son afines [10]. A estos núcleos se les agregó luego SDS, el cual es un solvente anfipático que ayudó a liberar los ácidos nucleicos de los núcleos, ya que este daña las interacciones hidrofóbicas de los componentes proteicos y lipídicos de la membrana nuclear y las histonas a las que esta acomplejado el ADN.
Posteriormente, esta fracción fue centrifugada dos veces agregando mezcla de extracción de cloroformo-fenol, con lo cual precipitan los componentes no polares diluidos en el cloroformo, que en este caso son todos los posibles restos de membrana nuclear y otros componentes proteicos y lipídicos, y se tiene entonces en el sobrenadante solo los componentes polares, entre ellos el ADN que se encuentra cargado positivamente [2]. Finalmente, este sobrenadante que contenía ADN fue mezclado con etanol frio, el cual al ser más apolar que polar disminuyó la solubilidad del ADN e hizo que este precipitara, pues además también compite por el agua con el ADN, el cual después de ser recogido se diluyó de nuevo en NaCl al 0,9%.
Contenido de ADN en el hígado de ratón empleado
El ADN tiene un máximo de absorción de luz a una longitud de onda de 260 nm [4], es por esto que se usó la absorbancia medida a esta longitud de onda para la cuantificación de esta molécula en el extracto de hígado. La cantidad de ADN obtenida (ver tabla I) fue bastante baja en contraste con lo reportado en la bibliografía, en las cuales ésta es de 2,49 [8] y 2,34 [9] mg de ADN por g de hígado de ratón (Mus musculus). Dicho resultado se puede atribuir a tres factores, el estado fisiológico del hígado, la sensibilidad del método y los errores durante el proceso de experimentación.
La cantidad de ADN extraído del hígado, depende directamente de la cantidad de células que este posea, y esto a su vez depende de la condición fisiológica en la que se encontraba el ratón, lo cual está relacionado con su alimentación. El alimento concentrado para ratas, generalmente empleado para alimentar ratones también, se ajusta a las necesidades nutricionales de estos roedores, así mismo, se sabe que este contiene un 3.15 % de grasas, proteínas un 26.52 % de proteínas crudas y un 53.34 % de carbohidratos [13].
El ratón empleado durante la experimentación estaba siendo alimentado con alimento comprimido para perros, la cual por lo general contiene de 15-19% de proteínas crudas, un 7,5 % de grasas crudas y apenas un 5 % de carbohidratos [14]. El contenido de carbohidratos y de proteínas en el alimento para perros es muy bajo en contraste con el alimento para ratas, las grasas son por otra parte muy altas en comparación con las necesidades nutricionales del ratón. Con este desbalance nutricional, era de esperarse que el ratón no tuviese la suficiente energía para todas sus funciones, y por consiguiente no estuviese en condiciones fisiológicas óptimas. Procesos como la replicación y la renovación celular, implican grandes cantidades de energía y de nutrientes que son adquiridos a través de la dieta. Al no haber la cantidad de nutrientes y energía necesarios para estos, entonces se puede esperar una disminución de las células del tejido hepático, ya que este es el que provee de glucosa y aminoácidos a las células cuando hay bajas concentraciones de estos en el resto del cuerpo [7] y por consiguiente la cantidad de ADN que se puede obtener de este órgano en total también disminuye.
Sin embargo, una deficiencia nutricional no puede usarse para explicar una disminución tan drástica en el contenido de ADN extraído del hígado del ratón, se debe entonces hacer foco en el método empleado. En uno los métodos usados por la referencia, el proceso de extracción fue completamente anulado, y se trató el tejido directamente con un conjunto de reactivos, entre ellos Triton X-100 al 0,2 %, los cuales permitieron la cuantificación espectroscópica [8] evitando pérdidas o contaminación durante la extracción. En otro estudio, se emplearon reactivos para degradar ARN y proteínas, disminuyendo así la contaminación de la muestra, y además, la extracción fue automatizada con la ayuda de aparatos electrónicos [9].
Si se compara, en la referencia el margen posible de errores con respecto a perdida de material y a contaminación del mismo durante la extracción, fue mínimo en comparación con el protocolo del estudio en cuestión. Finalmente, existe siempre la posibilidad de que durante la ejecución del protocolo, se hayan dado errores de apreciación de volúmenes, precisión de medidas, y otros relacionados al experimentador.
Caracterización del extracto de ADN
Absorción de luz y efecto hipercrómico
El estado físico de los ácidos nucleicos está relacionado con su capacidad de absorción de la luz ultravioleta (UV) a 260 nm. El menor grado de absorción se produce en estado de doble hélice, la absorción aumenta cuando se produce la desnaturalización pasando a estado de hélice sencilla (efecto hipercrómico, aumento de la absorbancia) [15].
Al principio en la muestra de ADN los enlaces de hidrógeno entre los pares de bases en la doble hélice limitaron el comportamiento de resonancia del anillo aromático de las bases que se tradujo en, la disminución de la absorbancia UV de ADN. Luego de la desnaturalización por calor, las bases se encontraban en forma libre y por ende, no se permite la formación de enlaces de hidrógeno con las bases complementarias, que se traduce en la absorbancia un 40% mayor a la misma concentración [16]. Este fenómeno, denominado efecto hipercrómico, se vio reflejado en el aumento en los valores de absorbancia luego de la desnaturalización por calor (Tabla II). Por otra parte, el ADN y el ARN, específicamente, presentan un máximo de absorbancia a 260 nm donde el ADN de doble cadena tiene una densidad óptica de 50 μg/ml [3], mientras que, las proteínas presentan su máximo de absorbancia a 280 nm [16]. En función de esto, el cálculo de la relación de de absorbancias 260/280 permite determinar si el ADN es más o menos puro en una muestra. Si éste se encuentra puro, el cociente estará entre 1,8 y 2, mientras que si está por debajo de 1,8 entonces la muestra contiene proteínas, y si está por encima de 2, contiene ARN [3]. El cociente de 1,5 obtenido señala contaminación por proteínas en la muestra de ADN extraída del hígado de ratón empleado. Dicha contaminación puede haberse dado en algún paso del proceso de extracción, en el que se mezcló accidentalmente el extracto con alguna porción mínima de la fracción proteica.
Determinación cualitativa de la presencia de fosfatos
Al agregar el molibdato de amonio, los grupos fosfatos de la cadena de ADN reaccionaron y dieron una coloración amarilla a la solución. Este resultado indica la presencia de grupos fosfato. La reacción en sí genera un precipitado amarillo de fosfomolibdato de amonio y se da en medio ácido (Fig. 5) [17].
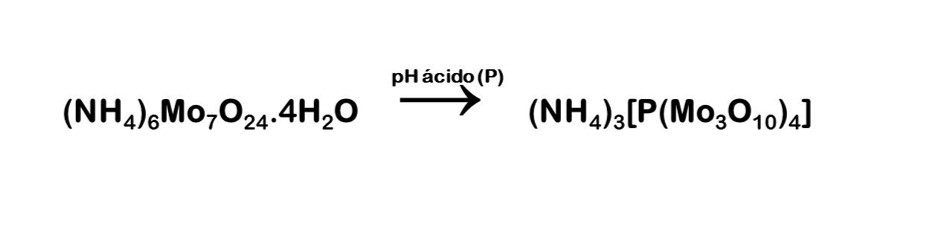
Figura 5: Reacción de la prueba de identificación de fósforo.
Esta reacción ocurre bajo la acción del H2SO4, que cataliza la hidrólisis ácida de los compuestos del fósforo del ADN, donde a su vez, es reducido a ácido fosfomolibdico en presencia del perhidrol que actúa como catalizador para la reducción del grupo fosfato del ADN. Dicho ácido fosfomolibdico, o fosfomolibdato de amonio, es de color amarillo en solución, por lo que sirve como indicador de la presencia de fósforo en el ADN [18]. Esta reacción, ocurrió de la manera descrita, permitiendo determinar la presencia del fósforo en forma de fosfato en la muestra.
Determinación cualitativa de la presencia de pentosas
Al añadir el reactivo de Bial, el cual está compuesto de HCl, orcinol y FeCl3, y al calentar, la solución se coloreó de verde, lo cual es positivo para la reacción de Bial. Esta reacción es general para pentosas y hexosas y lo que ocurre es que se da la formación de furfural en el caso de las pentosas a partir de la deshidratación con HCl concentrado, luego al calentar, el orcinol reacciona con el furfural en presencia del ión férrico como catalizador, dando un complejo con una coloración característica verdosa (Fig. 6) [6]. Sucede entonces que al hidrolizar por calor las hebras de ADN el HCl actúa como deshidratante de las moléculas de pentosa en el ADN y forma furfural que luego reacciona con el orcinol. Esto explica que la muestra se haya coloreado de un tono verdoso, siendo así positivo para la reacción e indicando la presencia de pentosas en la solución.
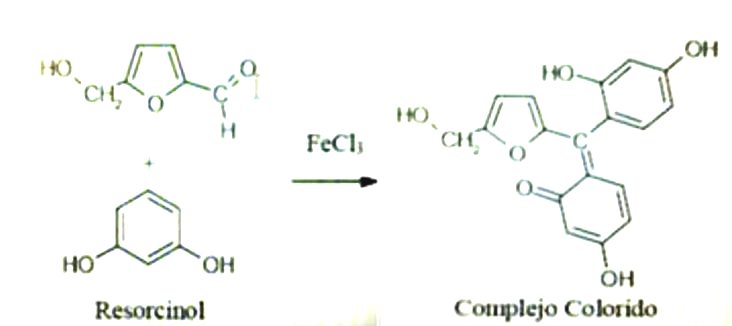
Figura 6: Reacción general de la prueba de Bial. Fuente.
CONCLUSIONES
•El hígado del ratón empleado para la experimentación (Mus musculus) contenía 0,2785 mg ADN/g. Además contenía aproximadamente 6,05x107 células por g.
•El peso aproximado de cada célula hepática de la muestra es 1,65x10-8 g.
•El extracto de ADN obtenido estaba ligeramente contaminado con proteínas.
•La alimentación puede influir en la cantidad de ADN que se obtiene del hígado de un individuo.
•El método empleado para la extracción, y la precipitación con etanol, es un procedimiento poco sensible y con un margen de error considerable.
•El extracto contenía grupos fosfato y pentosas, indicativo de que en efecto, si se aisló el ADN.
•Las absorbancia del ADN aumenta cuando este se desnaturaliza por calor.
REFERENCIAS BIBLIOGRÁFICAS
[1] Lehninger A. Bioquímica: las bases moleculares de la estructura y función celular. 2da edición. Barcelona: Ediciones Omega, S.A.; 1978. p 1117.
[2] Díaz J, Hicks J. Bioquímica. 2da edición. México: Nueva Editorial Interamericana, S.A.; 1995. p 749.
[3] Zavala J. Manual de técnicas básicas de biología molecular. México: Ediciones Universidad Autónoma de Yucatán; 2005. p 199.
[4] Fonseca D, Mateus H, Contreras N. Prácticas de laboratorio de biología molecular: su aplicación en genética básica. Rosario: Editorial Universidad del Rosario; 2010. p 72.
[5] Rozas C, Morani M. XIX Congreso Latinoamericano de Bioquímica Clínica. Santiago de Chile: Sociedad Chilena de Química Clínica; 2010. p 131.
[6] Rivera E. Prácticas de bioquímica descriptiva. México: Editorial UniSon; 2005. p 199.
[7] Koolman J, Röhm K. Bioquímica: texto y atlas. 3era edición. España: Editorial Médica Panamericana; 2004. P 479.
[8] Fiszer-Szafarz B, Szafarz D, Guevara A. A general, fast, and sensitive micromethod for DNA determination: application to rat and mouse liver, rat hepatoma, human leukocytes, chicken fibrobiasts, and yeast cells. Analytical biochermistry. 1981: 110: 165-170.
[9] Kirchgesser M, Adem C, Baumgartner A, Girgnhuber H, Malmberg W, Schmitt I, Nieswandt V, Eberle W. Automated isolation of DNA from tissue samples in 35-50 minutes: fast and easy purification combining the MagNA Lyser and the MagNA Pure Compact Systems. Biochemica. 2006: 1: 9-10.
[10] Lodish H. Biología celular y molecular. 5ta edición. España: Editorial Médica Panamericana; 2005. p 932.
[11] Plattner H, Hentschel J. Biología celular. 4ta edición. España: Editorial Médica Panamericana; 2014. p 536.
[12] Voet D, Voet J. Bioquímica. 3ra edición. Madrid: Editorial Médica Panamericana S.A.; 2006. p 1776.
[13] Kontar W, Santiago B, Ruiz J, Vit P. Explorando la calidad del alimento concentrado para ratas (ACR) utilizado en el bioterio de la Universidad de los Andes. Fuerza Farmacéutica. 2008: 1: 26-29.
[14] Purina Perrarina Plus Carne y Hueso [Internet]. Venezuela: Nestle, a gusto con la vida.
[15] Mejia M. Efecto hipercrómico del ADN. Biagro. 2011: 23(1): 27-34.
[16] Cruz A. Cuantificación y pureza del ADN por espectrofotometría. Colombia: Universidad de Bogotá; 2012.
[17] Pruebas cualitativas para la determinación de lípidos: experimento 10 [Internet]. Venezuela: Universidad de los Andes.
[18] Kastner M. Secreción de fósforo durante la absorción de azúcares: I métodos de determinación del fósforo. Mem. Inst. Oswaldo Cruz. 1959: 2(57): 199-217.
In my opinion, you post many beautifully.