Hola estimada comunidad de steemit, en esta oportunidad les describiré mediante este post el proceso de obtención (por contacto) de uno de los ácidos fuertes más utilizados a nivel mundial como es el caso del ácido sulfúrico H2SO4.
Propiedades del ácido Sulfúrico.
El ácido sulfúrico en su forma pura es un líquido aceitoso sin color y sin olor, en su forma comercial su coloración es pardusca.
Este ácido es soluble en agua y puede formar soluciones con esta en cualquier proporción, estas soluciones se nombran de acuerdo con el porcentaje en peso del ácido en la solución.
El ácido sulfúrico al 100% es también llamado anhídrido de trióxido de azufre o monohidrato de trióxido de azufre.
Propiedades del H2SO4.
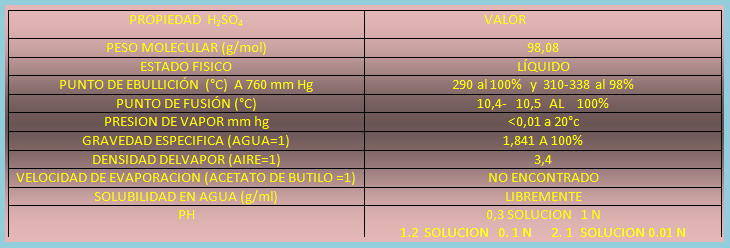 Imagen de redacción propia.
Imagen de redacción propia.
Importancia y aplicaciones del ácido sulfúrico.
El ácido sulfúrico es el ácido más importante desde el punto de vista industrial, se ha llegado a afirmar que el grado de desarrollo de un país, se puede medir por la cantidad de ácido sulfúrico que produce.
El ácido sulfúrico obtenido por el método de contacto y los sulfatos derivados son materias primas importantes en múltiples industrias, se utiliza entre otras cosas como deshidratante, como agente blanqueador, en la producción de éter, en la fabricación de fertilizantes y en la de alumbre (utilizado como agente coagulante).
También es utilizado en la industria de pigmentos, pegantes, purificación del petróleo, baños de electroplateados , herbicidas, en la refinación de aceites minerales y vegetales. Como agente en la fabricación de explosivos.
Descripción del método de contacto en la fabricación de ácido sulfúrico.
Este proceso comienza con el azufre extraído de las minas mediante el método de frash, que consiste en inyectar vapor de agua a elevada temperatura en la mina, para qué arrastre el azufre, este se obtiene casi puro, alrededor de un 99% de pureza.
Este azufre obtenido se utiliza en el método de contacto que consta de los siguientes pasos:
Primero el azufre se oxida de manera fácil y rápida a dióxido de azufre.
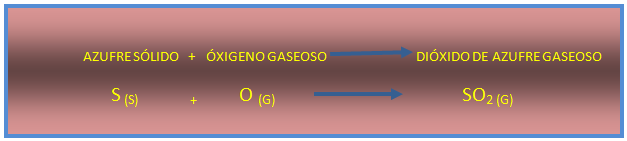 Imagen de redacción propia.
Imagen de redacción propia.
Luego el dióxido de azufre SO2 generado se hace pasar por una cámara que contiene pentóxido de vanadio V2O5 , como catalizador, en la cual se efectúa la siguiente reacción de equilibrio, donde el SO2 entra en contacto con el catalizador en presencia de aire.
Esta reacción es lenta a temperatura normal, pero si se efectúa por encima de 550°c y con el catalizador adecuado (v2o5 ) se logra el desplazamiento del equilibrio hacia la derecha en forma rápida, este es el paso crucial del proceso, además los gases SO2 y SO3 son contaminantes y por tanto debe controlarse su emisión a la atmosfera.
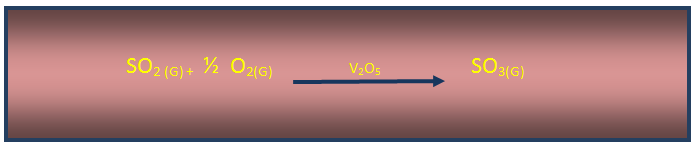 Imagen de redacción propia.
Imagen de redacción propia.
El trióxido de azufre (SO3) producido se burbujea a través de ácido sulfúrico H2SO4 concentrado con lo cual se obtiene el ácido disulfúrico H2S2O7, que se diluye para producir ácido sulfúrico H2SO4.
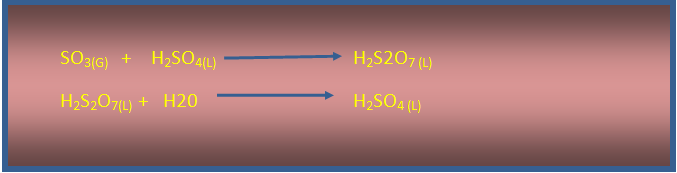 Imagen de redacción propia.
Imagen de redacción propia.
De esta manera se lleva a cabo este proceso de obtención de ácido sulfúrico con un alto rendimiento y poco tiempo de aplicación.
Cabe recordar que el conocimiento nunca se detiene, solo evoluciona espero que haya sido de su agrado el tema desarrollado me despido hasta un nuevo post………..
Referencias.
- Ácido sulfúrico.
http://documentacion.ideam.gov.co/openbiblio/bvirtual/018903/Links/Guia4.pdf
- Método de contacto.
Enciclopedia Lúmiina siglo XXI química pag 126.



