SISTEMAS AMORTIGUADORES DE PH EN LA SANGRE.
Hola comunidad steemit en general en esta oportunidad les escribiré del PH o soluciones amortiguadoras en la sangre, además de definir un poco los conceptos básicos asociados a este tópico..
Definición del PH.
En el año 1909 el químico danés Sorensen introdujo un método para expresar las concentraciones de iones hidrógeno utilizando el número del exponente en vez de usar su forma exponencial.
La escala de acidez desarrollada por Sorensen fue conocida posteriormente como la escala de PH, proveniente de los vocablos franceses pouvoir hydrogene (poder de hidrógeno). El PH es una forma práctica de indicar la acidez de una solución partiendo de la concentración en Molaridad (M) del ion de hidrógeno H+.
PH= - Log [H+]
Donde [H+] representa la concentración de iones de hidrógeno en M.
Escala del PH.
La escala del PH se representa mejor con la siguiente gráfica.
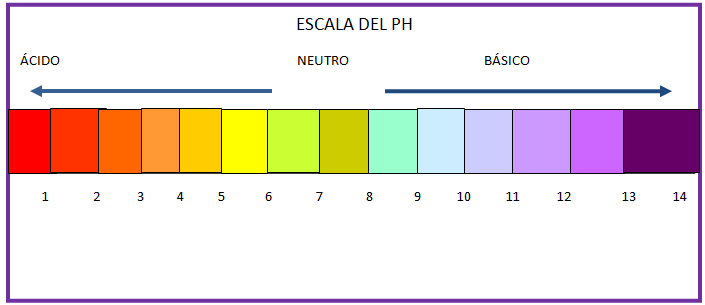
En donde el sector de la izquierda del 1 -6 representa soluciones con concentraciones de H+ ácidas el 7 representa concentraciones neutras y superiores al 7 concentraciones básicas.
Amortiguadores de PH.
Se denominan amortiguadores o buffer s a aquellas soluciones que resisten los cambios bruscos de PH cuando se agregan pequeñas cantidades de ácido o de base.
Estás son preparadas con un ácido o una base débil y una de sus sales, uno de los amortiguadores de PH más utilizados es el amoníaco y su sal de amonio que forman el buffer NH4 CL / NH3.

AMORTIGUADORES BUFFERS EN LA SANGRE.
El PH de la sangre en las personas se mantiene constante, si su valor está por debajo de los 7,35 se denomina acidosis y si estuviera por encima de los 7,45 se denominaría alcalosis.
En caso de que el valor del PH subiera a más de 7,8 o bajara a menos de 6,8 debido a dificultades respiratorias, inanición, insuficiencia renal o alguna enfermedad, la persona podría sufrir daño cerebral o incluso morir.
Para evitar esto la sangre humana cuenta con al menos 2 sistemas amortiguadores, siendo el más importante el buffer hidrógenocarbonato/ ácido carbonico HCO3- / H2CO3 - .
Las reacciones asociadas a este buffer son:
Al llegar ácidos (H+) a la sangre, estos son capturados por los iones de hidrogenocarbonato (HCO3-) Para formar ácido carbónico.

El Ácido carbónico formado H2CO3 se ioniza en baja proporción para formar iones de H+ Y hidrogenocarbonato en solución.

Cualquier base que entre al torrente sanguíneo eliminara los iones H+ para formar H2O, y mientras se consumen las moléculas de H2CO3 se van formando muchas más cantidades de esté por el dióxido de carbono presente en la sangre.
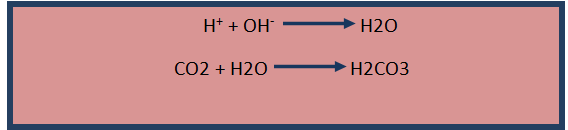
El segundo buffer sanguíneo es el dihidrogenofosfato H2PO4- Y el monohidrogenofosfato HPO4= según la reacción.

De esta manera nuestra química sanguínea nos asegura un PH estable para ejecutar eficientemente las funciones biológicas del torrente sanguíneo.
Espero que sea de su agrado el tema que hoy comparto con ustedes, hasta un nuevo post @harlyntvaq
Referencias.
- ESCALA DE PH.
http://conceptodefinicion.de/ph/#!/bounceback
- PH SANGUÍNEO.
Enciclopedia santillana química 1era edición 2007 pag 45
Great idea! I like your thought behind it. Check my post as well
Thankyou for posting this. This really broden my horizon. Take a look at my post as well
Great Read! Check out my post as well.
gracias por el apoyo brindado ...............